Pengertian, Sifat, Teori Asam dan Basa
A. PENGERTIAN ASAM DAN BASA
Kata “asam” berasal dari bahasa
Latin “acidus” yang berarti masam.
Asam adalah zat (senyawa) yang menyebabkan rasa masam pada berbagai materi.
Basa adalah zat(senyawa) yang dapat beraksi dengan asam, menghasilkan senyawa
yang disebut garam. Sedangkan basa adalah zat-zat yang dapat menetralkan asam.
Secara kimia, asam dan basa saling berlawanan. Sifat basa pada umumnya
ditunjukkan dari rasa pahit dan licin.
Asam dan basa sangat erat
kaitannya dalam kehidupan kita, didalam tubuh manusia juga terdapat
keseimbangan asam basa untuk beradaptasi dan tetap menjaga fungsinya dengan
baik. Contohnya saja seperti asam lambung yang dapat membunuh mikroorganisme yang
terdapat pada makanan yang kita konsumsi. Begitu juga dengan gaya hidup kita
sehari-hari sangat sering dihadapkan dengan asam basa tersebut, seperti asam
cuka, minuman bersoda, jeruk, aki bersifat asam. Sedangkan sabun dan bahan
pembuatan pupuk yang bersifat basa. Beberapa hewan tertentu juga mempertahankan
diri dengan menghasilkan basa, seperti sengatan tawon.
 |
| ASAM DAN BASA |
B. TEORI ASAM DAN BASA
Teori Asam-Basa dikemukakan oleh
beberapa ilmuwan, salah satunya adalah Teori
Arrhenius yang mengatakan Asam adalah suatu sifat yang mana berupa
senyawa yang dapat melepas ion hidrogen (H+) jika dilarutkan dalam air,
Sedangkan basa merupakan suatu sifat yang mana berupa senyawa yang dapat
melepas ion hidroksida (OH-) jika dilarutkan dalam air. Reaksi asam basa
(reaksi penetralan) adalah reaksi pembentukan H2O dari ion-ion H+ dan OH-.
Teori lainnya dikemukakan yaitu Teori Bronsted-Lowry yang mengatakan asam
berupa senyawa yang dapat memberi proton (H+) kepada senyawa lain, sedangkan basa
dapat menerima proton (H+) dari senyawa lain. Reaksi asam basa adalah reaksi
perpindahan proton dari satu senyawa ke senyawa yang lain.
Teori terakhir
yaitu Teori Lewis yang mengatakan Asam
adalah senyawa yang dapat
Menerima
pasangan elektron bebas dari senyawa lain, sedangkan Basa adalah senyawa
yang dapat memberi pasangan elektron bebas kepada spesi (senyawa) yang lain.
Reaksi asam basa adalah adalah reaksi pembentukan ikatan antara asam dan basa.
C. SIFAT ASAM DAN BASA
1. Sifat-sifat
asam yaitu :
- Rasanya masam/asam
- Bersifat korosif atau merusak
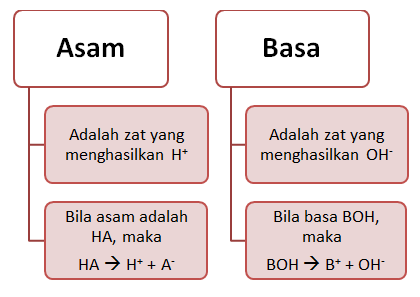
- Bila dilarutkan dalam air dapat menghasilkan ion H+ atau ion ion hidrogen dan ion sisa asam yang bermuatan negatif. Peristiwa terurainya asam menjadi ion-ion dapat di tuliskan sebagai berikut:
HA (aq) à H+ (aq) + A-
(aq)
- Bila diuji dengan indikator kertas lakmus biru dapat mengubah lakmus tersebut menjadi merah. Sedangkan jika diuji dengan indikator kertas lakmus yang berwarna merah, kertas lakmus tersebut tidak akan berubah warna. Indikator adalah suatu alat untuk menunjukkan suatu zat apakah bersifat asam maupun basa.
2. Sifat-sifat
basa yaitu:
- Rasanya pahit
- Bersifat kaustik atau dapat merusak kulit
- Bila dilarutkan dalam air dapat menghasilkan ion OH- atau ion hidroksil dan ion logam atau gugus lain yang bermuatan negatif. Apabila ion OH- hampir seluruhnya dilepaskan atau ionisasinya sempurna, maka termasuk basa kuat atau dikatakan memiliki derajat keasaman yang rendah dan begitu juga sebaliknya. Secara umum peristiwa peruraian basa menjadi ion-ion dapat dituliskan sebagai berikut:
BOH (aq) à B+ (aq) + OH-
(aq)
- Bila diuji dengan indikator yang berupa lakmus merah, maka akan mengubah warna lakmus tersebut menjadi warna biru, sedangkan dengan kertas lakmus biru, tidak akan mengubah warna kertas lakmus tersebut.
D. PERBEDAAN ASAM DAN BASA
Rangkuman
perbedaan asam dan basa dapat dituliskan sebagai berikut :
 |
| SIFAT SIFAT ASAM DAN BASA |
 |
| SIFAT SIFAT ASAM DAN BASA 2 |
E. KESEIMBANGAN ASAM DAN BASA
Keseimbangan
asam dan basa terdapat pada beberapa makhluk hidup, contohnya saja manusia.
Keseimbangan asam basa adalah homeostasis dari kadar hidrogen didalam tubuh.
Kadar normal ion hidrogen (H) didalam darah yaitu 4x10-8 atau dengan pH = 7,4.
Keseimbangan ini penting untk mengendalikan afinitas Hb terhadap O2 (kemampuan
mengikat), yang mana ketika terjadi gangguan keseimbangan asam dan basa di
dalam tubuh, maka akan mengganggu beberapa sistem seperti pernafasan dan
pencernaan
Keadaan dimana
konsentrasi ion hidrogen atau pH terlalu tinggi, disebut dengan asidosis, sendangkan keadaan yang mana
konsentrasi ion hidrogen atau pH terlalu rendah disebut dengan alkalosis. Agar tidak terjadi dua
kelainan tersebut maka diperlukan pengatur khusus, yaitu:
- Sistem penyangga (buffer) asam-basa yang segera bergabung dengan asam atau basa yang kemudian akan mencegah terjadinya perubahan pH atau konsentrasi ion hidrogen yang berlebihan.
- Apabila konsentrasi ion hidrogen berubah, maka pusat pernafasan di otak akan teransang atau terstimulasi untuk mengubah kecepatan pernafasan pada paru-paru, yang akan mengakibatkan perubahan kecepatan pengeluaran karbondioksida dari tubuh sehingga akan membuat konsentrasi ion hidrogen kembali normal.
- Perubahan konsentrasi ion hidrogen juga akan menyebabkan ginjal mengeluarkan urin yang bersifat asam atau basa tergantung senyawa apa yang berlebih, sehingga membantu konsentrasi ion hidrogen didalam cairan tubuh kembali nomal.
- Sistem buffer ini dapat bekerja dalam sepersekian detik untuk mencegah perubahan konsentrasi ion hidrogen secara berlebihan. Sebaliknya sistem pernafasan membutuhkan waktu 1-3 menit untuk menyesuaikan kembali konsentrasi ionhidrogen setelah terjadinya perubahan mendadak. Kemudian ginjal yang merupakan komponen pengatur asam-basa yang paling kuat, memerlukan waktu beberapa jam hingga lebih dari 24 jam untuk menyesuaikan kembali konsentrasi ion hidrogen tersebut.
F. KEKUATAN ASAM DAN BASA
Suatu asam atau
basa disebut kuat jika terurai
sempurna (atau mendekati sempurna) di dalam air, kekuatan ini disebut juga
dengan kekuatan ionisasi.
Beberapa contoh
asam kuat yaitu: HCl, HBr, H2SO4, HNO3, HI, HIO4, dan HbrO4. Sedangkan beberapa
contoh basa kuat yaitu: NAOH (natrium hidroksida), KOH (kalium hidroksida),
Ba(OH)2 dan juga yang berasal dari golongan alkali (golongan IA) seperti Na dan
K, dan logam alkali tanah (golongan IIA) seperti Mg, dan Ca.
Asam dan basa
yang lemah tidak akan terurai atau terionisasi secara sempurna ketika
dilarutkan kedalam air. Contohnya asam lemah seperti HA. Sedangkan basa lemah
contohnya adalah NH4OH (ammonium hidroksida)
Nah itulah postingan kali ini tentang ASAM DAN BASA, semoga ilmunya dapat bermanfaat. Apabila masih ada yang belum dimengerti silahkan sahabat tanyakan melalui kotak komentar di bawah ini, kami akan berusaha merespon dengan cepat dan tepat. Terimakasih telah berkunjung di fathchemical, jangan lupa follow dan like nya ya :)
Asam dan Basa dalam tubuh jika kurang seimbang berarti jadi penyakit juga ya min?..
ReplyDeleteseperti halnya yang saya alami jika asam lambung saya naik mungkin saya harus memasukan zat yang bersifat basa ke dalam tubuh supaya asam dan basa nya seimbang lagi. Zat basa itu ada pada jeruk nipis kalau gak salah saya pernah baca zat basa dalam buah-buahan.
salam
BLOG MAS USMAN