1. Hukum kekekalan massa
Selama perubahan (reaksi) kimia
berlangsung, tidak ada massa yang dapat diciptakan atau dimusnahkan atau dalam
suatu reaksi kimia, massa sesudah reaksi sama dengan massa sebelum reaksi.
2. Hukum Perbandingan Tetap
Setiap zat tersusun atas
unsur-unsur dengan perbandingan berat yang tetap
Misal : KCl
3. Hukum Kelipatan Berganda
Apabila dari dua unsur A dan B yang
dapat dibuat persenyawaan
lebih dari satu macam, maka berat
unsur A yang bergabung dengan unsur
B yang beratnya sama merupakan
kelipatan bilangan bulat
Misal : A = N
B = O
Senyawa yang dapat terbentuk :
misal : N2O ; NO ; NO2
Teori Atom
Dalton
Berdasar pada ketiga hukum
dasar, John Dalton mengajukan satu hipotesis tentang materiyang populer dengan
“ Teori Atom Dalton”
- Semua zat tersusun atas partikel yang tidak dapat dibelah lagi dan disebut “atom”
- Atom suatu unsur memiliki sifat yang sama, atom unsur yang berbeda memiliki sifat yang berlainan
- Atom bersifat kekal, tidak dapat diciptakan atau dimusnahkan
- Reaksi kimia apat terjadi karena penggabungan, pemisahan atau pengaturan kembali atom-atom yang terlibat dalam suatu reaksi kimia.
Konsep Berat
(massa) Atom dan Rumus MolekulDefinisi :
Mx = Berat (massa)
atom X
mx = berat satu atom X
ms = berat satu atom unsur yang digunakan
sebagai pembanding ( C12 )
Sistem Periodik Unsur
2.Dalam suatu periode ; makin kekanan letak suatu unsur dalam tabel periodik, jari-jari atom unsur itu umumnya
§Keragaman sifat dari unsur mendorong untuk mengelompokkan unsur berdasar sifat yang dimiliki masing-masing unsur
§Berbagai sistem periodik unsur pernah digunakan orang. Susunan sistem periodik unsur yang banyak digunakan adalah dalam bentuk tabel sehingga dikenal sebagai Tabel Sistem periodik Unsur.
§Tabel ini disusun berdasarkan nomor atom.


BEBERAPA SIFAT PRODUK PERIODIK
PENTING
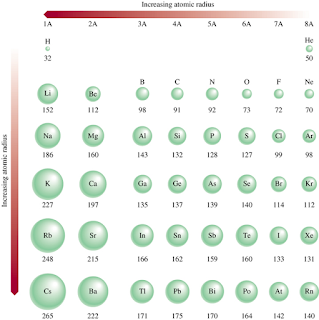
Jari-Jari
Atom
Jari-jari atom suatu
unsur
adalah jarak rata-rata antara inti atom dengan elektron terluar dalam atom itu.
Dari jari-jari atom menujukkan adanya sifat periodik berikut :
1.Dalam
suatu
golongan ; makin kebawah letak suatu unsur dalam tabel periodik, jari-jari atom unsur
itu
umumnya semakin besar.
2.Dalam suatu periode ; makin kekanan letak suatu unsur dalam tabel periodik, jari-jari atom unsur itu umumnya
Secara teoritis, jari-jari atom suatu unsur ditentukan oleh tiga
faktor :
1. Muatan inti :
Makin besar muatan inti suatu atom, makin kecil jari-jari
atom unsur itu ; karena dengan bertambahnya muatan inti, maka gaya tarik inti
terhadap elektron akan semakin kuat.
2. Bilangan Kuantum Utama Elektron Terluar :
Makin besar harga bilangan kuantum utama (n) elektron yang
terluar suatu atom maka makin besar pula jari-jari atomnya, karena jarak
elektron terluar dengan inti atom berbanding lurus dengan n2 (ingat model atom
Rutherford-Bohr).
3. Jumlah Elektron dalam Atom :
Makin besar jumlah elektron dalam suatu atom maka makin
besar pula jari-jari atomnya, karena bertambahnya jumlah elektron dalam suatu
atom akan memperkuat gaya tolak antar elektron.
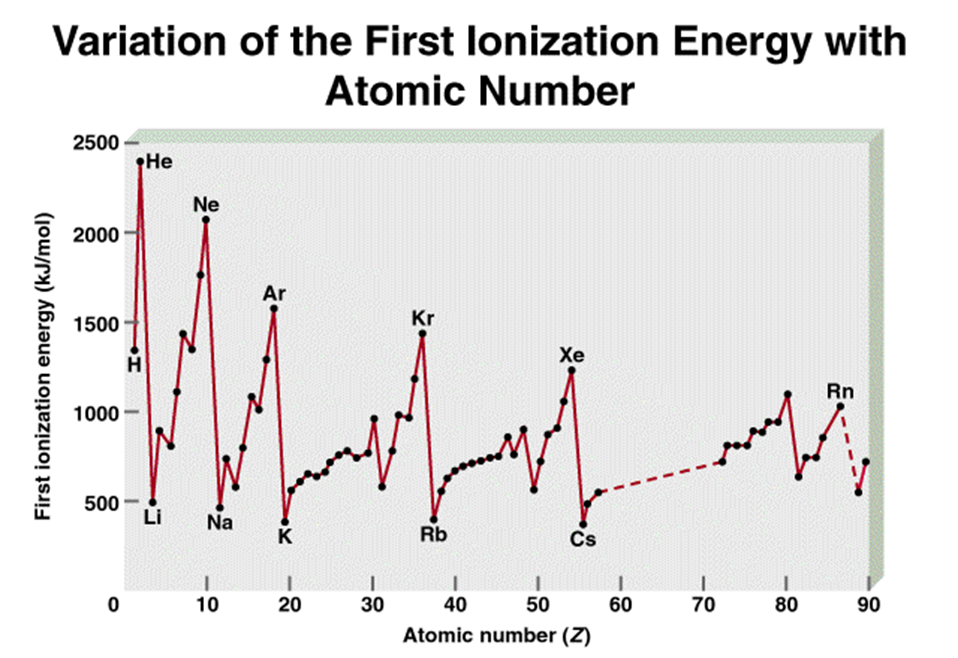
Potensial (Energi)
Ionisasi
Potensial Ionisasi suatu unsur adalah energi yang
diperlukan untuk melepaskan satu elektron yang terikat paling lemah dari suatu
atom netral atau dari suatu ion.
Al
→ Al+ + e- PI
tingkat pertama
Al+
→ Al2+ + e- PI
tingkat kedua
Al2+→
Al3+ + e- PI
tingkat ketiga
Sifat sistem periodik unsur :
1.
Dalam suatu golongan, makin kebawah letak suatu unsur
dalam tabel periodik, potensial ionisasi itu akan semakin rendah.
2.
Dalam suatu perioda, makin kekanan letak suatu unsur
dalam tabel periodik, potensial ionisasi unsur itu akan semakin tinggi.
Sifat ini
akan dapat diterangkan dengan mudah berdasarkan sifat periodik jari-jari atom.
Elektronegativitas
Sistem periodik :
1.Dalam
suatu
golongan, makin kebawah letak suatu unsur dalam tabel periodik, elektonegativitas unsur itu akan semakin rendah
2.Dalam
suatu
perioda, makin kekanan letak suatu unsur dalam tabel periodik, elektronegativitas unsur itu akan semakin tinggi.
0 Response to "Hukum Dasar Ilmu Kimia"
Post a Comment